Proteínas 1(Ensayos de reconocimiento de proteínas)
1)Resúmen del trabajo realizado:
Lo realizado en la experiencia fue la obtención de proteínas a partir de ciertas sustancias.Mediante los ensayos de Biuret y Xantoproteico nuestro fin fue determinar la naturaleza proteica de muestras como la caseína,ovoalbúmina,gelatina,aspartamo,glicina y suero de leche.
Por una lado,el ensayo de Biuret permite detectar la presencia de compuestos con dos o más enlaces peptídicos .Por otro lado,el ensayo de Xantoproteico permite identificar la aromaticidad dada por la presencia de un grupo fenilo en la molécula proteica.En particular,en la tirosina. Dichos ensayos se explicarán en detalle posteriormente.
2)Objetivos,materiales y reactivos utilizados
Objetivos:extraer proteínas de algunas sustancias para luego reconocer su naturaleza proteica
Materiales:
- Varilla de vidrio -Ácido etanoico 2,0 M
- Mechero - Hidróxido de sodio al 10%
-Soporte - Sulfato cúprico al 1%
- Tela metálica -Ácido nítrico concentrado
- Gradilla
- Tubos de ensayo
- Termómetro
-Papel de filtro
3)Fundamentos de la técnica
Las proteínas son compuestos de aminoácidos que combinan elementos químicos tales como el carbono, el oxígeno, el hidrógeno y el nitrógeno.A su vez constituyen la estructura básica de todas las células vivas y son esenciales para la formación y mantenimiento del organismo,formando parte de las moléculas constituyentes de los seres vivos(biomoléculas) y siendo de máxima importancia dentro de este grupo.
 | |
| Molécula de CH4(formada por carbono | ,uno de los elementos formadores de los aminoácidos) |
Cuando se analiza un esquema de purificación de una proteína , cuando se quiere conocer la actividad específica de una preparación de enzimas, para diagnosticar enfermedades, así como para otros muchos fines,determinar la concentración de proteínas en una muestra biológica es esencial.
Para la cuantificación de proteínas existen determinados métodos que se basan en las propiedades de estas como son la capacidad que tienen las proteínas de unir ciertos colorantes,la formación de derivados químicos y la absorción de luz en el UV.
Ensayo de Biuret Positivo:
Para determinar si el mismo resulta positivo o negativo se debe observar si el reactivo cambia de color.
Cuando resulta positivo(es decir,existe presencia de proteínas),el color azul caracteristico del reactivo,cambiará a violeta.Sin embargo,la reaccion de Biuret no es exclusiva para las proteinas,por lo que es necesario tener en cuenta máximas precauciones para evitar obtener resultados falsos positivos.
Ensayo de Biuret negativo:
Cuando el reactivo es de un color azul claro al finalizar el ensayo,el mismo ha dado negativo y por lo tanto se suele decir que esto se debe a la ausencia de proteinas en la muestra.Esto es correcto,pues es una posibilidad.Es decir,una de las causas por las que podria dar negativo seria que no existan proteínas o péptidos en la muestra (ni tampoco otras sustancias no proteicas biuret positivas)Sin embargo,es incorrecto afirmar que siempre que resulta negativo se da por lo anterior ya que pueden haber diversos factores como:
- que existan una o más sustancias que intervengan en la muestra:Por ejemplo,si mi proposito es detectar péptidos producidos gracias a una reacción de hidrólisis ácida,debido a que la reacción de Biuret necesita alcalinizarse para formar el complejo con Cu++ los H+ del medio van a interferir con la reacción del biuret,por lo que es importante alcalinizar el medio previo a realizar el ensayo.De lo contrario,se obtendría un falso negativo.
- que haya presencia de peptidos pero que su concentracion sea inferior al valor minimo de concentracion necesario para que el metodo sea sensible.Es decir,sólo se puede determinar la presencia de péptidos sólo si la concentración de los mismos es superior a determinado valor
Detectar la presencia de compuestos con dos o más enlaces peptídicos por lo cual , sirve para todas las proteínas y péptidos cortos.
Ensayo de Xantoproteico positivo:
Para determinar si el ensayo tuvo un resultado positivo,se debe observar si el reactivo torna de color.Si torna de color,la solucion se volvera de un color amarillento oscuro lo que nos permitirá afirmar que se trata de un resultado positivo(Dicho ensayo se lleva a cabo a través de la utilización de HNO3 a una concentracion considerable,lo que hace que el color de la solución cambie una vez detectada la existencia de aminoácidos con restos aromáticos o proteínas)
 |
| Molécula de HNO3 |
Ensayo de Xantoproteico negativo:
Cuando el reactivo es incoloro al finalizar el ensayo,el mismo ha dado negativo
Objetivo del ensayo:
Determinar la presencia de proteínas solubles en una solución, a través de la utilización de ácido nítrico concentrado.
4)Descripción del modo de acción de los reactivos
Reactivo de Biuret
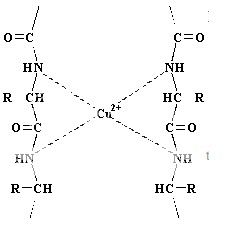
Esta constituído por hidróxido potásico (KOH) y sulfato cúprico (CuSO4), junto con tartrato de sodio y potasio (KNaC4H4O6·4H2O). El reactivo, de color azul, cambia a violeta en presencia de proteínas, y cambia a rosa cuando se combina con polipéptidos de cadena corta.Estas proteínas o péptidos se tratan para dicho ensayo con Cu++ en medio alcalino( Así es que el Hidróxido de Potasio no participa en la reacción, pero proporciona el medio alcalino necesario para que tenga lugar),lo cual es el factor determinante para que se produzca la coloración violácea de la que hablamos anteriormente ya que esta tiene lugar una vez que hay una formación de un complejo de coordinación entre el Cu++ y los pares electrónicos libres de los nitrógenos de los grupos amino de la unión peptídica. Son necesarias por lo menos dos uniones peptídicas para que tenga lugar la reacción.
Reactivo de Xantoproteico
Como se menciono anteriormente se realiza mediante el uso de HNO3 concentrado por lo que se puede considerar como
una sustitución electrofílica aromática de los residuos de tirosina de
las proteínas debido a la acción de dicho compuesto(hno3) dando un compuesto coloreado amarillo
a pH ácido.

 | ||
| Tirosina |
 | |
| Triptófano |

El que se produzca este compuesto amarillo al añadir ácido nitrico significa en relación a lo anterior que dichas proteínas contienen restos de tirosina o tiptofano.A su vez,el aumento de intensidad de ese color es provocado por la adición de base fuerte,por lo que es normal que el color del compuesto vacile entre matices que van del amarillo oscuro al naranja.
5)Informacion sobre estructura y funcion de las muestras sometidas a ensayo
Caseína:
 La caseína es un conjunto heterogéneo de aminoácidos y representa el 84% de las proteínas lácteas.Dichos aminoácidos resultan ácidos por lo que las proteinas que estos forman tambien lo son.Debido a esto la caseína precipita cuando se acidifica(con determinado ácido)la leche hasta alcanzar el PH correspondiente a su punto isoeléctrico,el cual es 4,6(Por ello, a la caseína también se le suele denominar proteína insoluble de la leche).Esto sería una causa "artificial" de la precipitación debido a ácidos.Sin embargo,la leche puede también precipitarse debido a la acción bacteriana,responsable de la formación de ácido láctico en la lactosa.
La caseína es un conjunto heterogéneo de aminoácidos y representa el 84% de las proteínas lácteas.Dichos aminoácidos resultan ácidos por lo que las proteinas que estos forman tambien lo son.Debido a esto la caseína precipita cuando se acidifica(con determinado ácido)la leche hasta alcanzar el PH correspondiente a su punto isoeléctrico,el cual es 4,6(Por ello, a la caseína también se le suele denominar proteína insoluble de la leche).Esto sería una causa "artificial" de la precipitación debido a ácidos.Sin embargo,la leche puede también precipitarse debido a la acción bacteriana,responsable de la formación de ácido láctico en la lactosa.

Ovoalbúmina
5)Informacion sobre estructura y funcion de las muestras sometidas a ensayo
Caseína:
 La caseína es un conjunto heterogéneo de aminoácidos y representa el 84% de las proteínas lácteas.Dichos aminoácidos resultan ácidos por lo que las proteinas que estos forman tambien lo son.Debido a esto la caseína precipita cuando se acidifica(con determinado ácido)la leche hasta alcanzar el PH correspondiente a su punto isoeléctrico,el cual es 4,6(Por ello, a la caseína también se le suele denominar proteína insoluble de la leche).Esto sería una causa "artificial" de la precipitación debido a ácidos.Sin embargo,la leche puede también precipitarse debido a la acción bacteriana,responsable de la formación de ácido láctico en la lactosa.
La caseína es un conjunto heterogéneo de aminoácidos y representa el 84% de las proteínas lácteas.Dichos aminoácidos resultan ácidos por lo que las proteinas que estos forman tambien lo son.Debido a esto la caseína precipita cuando se acidifica(con determinado ácido)la leche hasta alcanzar el PH correspondiente a su punto isoeléctrico,el cual es 4,6(Por ello, a la caseína también se le suele denominar proteína insoluble de la leche).Esto sería una causa "artificial" de la precipitación debido a ácidos.Sin embargo,la leche puede también precipitarse debido a la acción bacteriana,responsable de la formación de ácido láctico en la lactosa.
Ovoalbúmina
Las proteínas
de la clara de huevo entran dentro de la definición de glicoproteínas,
que son proteínas que llevan enlazados contenidos diversos de glúcidos a
la cadena de aminoácidos. Entre éstas, la más abundante es la
ovoalbúmina,(ocupa un60-65% del
peso de la clara de huevo) que es una fosfoglicoproteína.
La ovalbúmina es la principal proteína de la clara del huevo y la
que le da sus propiedades características (junto con la otra albúmina no fosforada).
La ovalbumina es, pues, una fosfoglicoproteína de 385 restos de aminoácido con un peso molecular aproximado de unos 42.7 KDa. Es una proteína de referencia en bioquímica y es conocida a la industria alimentaria por sus propiedades como transportadora, estabilizadora y formadora de emulsiones. Se desnaturaliza por calor a los 78ºC (temperatura de semidesnaturalización) perdiendo su estructura replegada de albúmina y produciendo un gel con gran retención de agua.
La ovalbúmina es la principal proteína de la clara del huevo y la
que le da sus propiedades características (junto con la otra albúmina no fosforada).
La ovalbumina es, pues, una fosfoglicoproteína de 385 restos de aminoácido con un peso molecular aproximado de unos 42.7 KDa. Es una proteína de referencia en bioquímica y es conocida a la industria alimentaria por sus propiedades como transportadora, estabilizadora y formadora de emulsiones. Se desnaturaliza por calor a los 78ºC (temperatura de semidesnaturalización) perdiendo su estructura replegada de albúmina y produciendo un gel con gran retención de agua.
La desnaturalizcion puede ocurrir por ejemplo a la hora de cocinar huevos.
Cuando la temperatura es elevada aumenta la energía cinética de las moléculas y destruye las interacciones débiles que mantienen la estructura terciaria. Al desorganizarse y su interior hidrofóbico entrar en contacto con un medio acuoso, se agregan y precipitan.
Animación de la desnaturalización de proteínas en huevo:
http://www.sumanasinc.com/webcontent/animations/content/proteinstructure.html
Gelatina
La gelatina es una mezcla coloide (es decir, una sustancia semisólida), incolora, translúcida, quebradiza e insípida, que se obtiene a partir del colágeno procedente del tejido conectivo de animales hervidos con agua.
Cuando la temperatura es elevada aumenta la energía cinética de las moléculas y destruye las interacciones débiles que mantienen la estructura terciaria. Al desorganizarse y su interior hidrofóbico entrar en contacto con un medio acuoso, se agregan y precipitan.
Animación de la desnaturalización de proteínas en huevo:
http://www.sumanasinc.com/webcontent/animations/content/proteinstructure.html
Gelatina
 | |
| Colageno |
La gelatina es una mezcla coloide (es decir, una sustancia semisólida), incolora, translúcida, quebradiza e insípida, que se obtiene a partir del colágeno procedente del tejido conectivo de animales hervidos con agua.
La
gelatina es una proteína compleja, es decir, un polímero compuesto
por aminoácidos. Como sucede con los polisacáridos, el grado de
polimerización, la naturaleza de los monómeros y la secuencia en la
cadena proteica determinan sus propiedades generales. Una notable
propiedad de las disoluciónes de esta molécula es su comportamiento
frente a temperaturas diferentes: son líquidas en agua caliente y se
solidifican en agua fría.
La gelatina
se utiliza en la fabricación de alimentos para el enriquecimiento
proteínico, para la reducción de hidratos de carbono y como sustancia
portadora de vitaminas.La misma se puede obtener a partir del colágeno presente en la piel,tendones,sistema vascular y otros materiales de desecho.La misma es extraída por calentamiento tras un tratamiento en medio ácido o
alcalino.La gelatina es un material altamente utilizado en tecnología de los alimentos, para la obtención de geles reversibles térmicamente, de punto de "fusión" muy bajo. Estos geles se forman por enfriamiento mediante la unión de cadenas por reconstrucción parcial de hélices del tipo de las del colágeno, pero con grandes zonas desorganizadas.
Aspartamo
El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa
 |
| Aspartamo |
Muchas veces hemos oído el nombre de este compuesto, sobre todo a la hora de hablar de productos light y bajos en calorías. Pues bien, el aspartamo es un edulcorante que se introduce en

Este compuesto fue descubierto en 1965 y está formado por por 2 aminoácidos, en concreto, la L-Fenilalanina y el ácido L-Aspártico.
El aspartamo tiene 4 kcal por cada gramo, y aunque està compuesto por aminoácidos, solo se necesita una muy pequeña cantidad para endulzar los alimentos, por lo que es considerado una sustancia no calórica, la energía que aporta no es significativa y por eso se desprecia.Esta dulzura relativa es de 150 a 200 veces mas dulce que el azucar(el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa ya que los edulcorantes se clasifican con respecto al azucar comun o la sacarosa)
Glicina
La glicina es uno de los aminoácidos que forman a las proteínas de los seres vivos.Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. Su fórmula química es NH2CH2COOH y su masa es 75,07. La glicina es un aminoácido no esencial. Otro nombre (antiguo) de la glicina es glicocola.
  |
| Glicina |
Suero de leche
Obtenemos suero de leche a partir de la fabricacion del queso y la caseina, después de la separación de la cuajada o fase micelar. Tiene como caracteristicas ser un liquido fluido,de color verdoso amarillento, turbio, de sabor fresco, débilmente dulce, de carácter ácido, con un contenido de nutrientes o extracto seco del 5,5% al 7% provenientes de la leche.
6)Descripción de los ensayos efectuados con cada muestra e interpretacion de los resultados obtenidos
CaseÍna
Procedimiento:
Para obtener la caseina y posteriormente realizarle los ensayos de Biuret y Xantoproteico,colocamos 25 ml aproximadamente de leche descremada en un vaso de Bohemia.Luego calentamos hasta aproximadamente 40 ºC con ayuda de la varilla de vidrio.Posteriormente,añadimos ácido etanoico 2,0 M(gota a gota) agitando en forma continua hasta que alcance la coagulación total.Luego separamos el coágulo de caseína del suero mediante filtración.Seguidamente,secamos cuidadosamente la caseína con ayuda del papel de filtro.Finalmente separamos dos porciones del sólido obtenido 1cm3 y lo colocamos en dos tubos de ensayo.
Ensayos efectuados:
Biuret:
Para la reaccion de biuret agregamos sobre la caseina de unos de los tubos 20 gotas de NaOH al 10 % luego agregamos 2 gotas de solucion CuSO4 al 1%
En el ensayo de biuret, la muestra se tornò violeta como se muestra en la foto, por lo cual podremos afirmar que la muestra posee al menos 2 enlaces peptìdicos
Xantoproteico:
Para la reacción de xantoproteico agregamos sobre la caseina del segundo tubo 10 gotas de HNO3 concentrado. Realizado el ensayo de Xantoproteico la solución se torna color amarillo como se ve en la foto. Por ende esto nos indica la presencia de tirosina o triptófano en la caseina
Ovoalbúmina
Procedimiento:
Para obtener la ovoalbumina rompimos un huevo,separamos la clara de la yema y removimos la clara,colocandola en agua.Luego colocamos parte de la solución en dos tubos de ensayo y finalmente realizamos las dos reacciones mencionadas.Luego realizamos los ensayos de Biuret y Xantoproteico ya mencionados.
Ensayos efectuados:
Biuret
la solución se torna color violeta por lo tanto se puede deducir que la ovoalbúmina presenta por lo menos dos o más enlaces peptidicos.
Xantoproteico
la solución se torna color amarillo por ende esto nos indica la presencia de tirosina o triptófano en la ovoalbúmina
Gelatina
Procedimiento:
Preparamos la gelatina incolora, la colocamos en dos tubos de ensayo (dos diferentes muestras) para realizar posteriormente ambas reacciones.
Ensayos efectuados:
Biuret
el ensayo de biuret dio positivo como muestra la fotografía por lo cual entendemos que hay por lo menos mas de dos enlaces peptìdicos.
xantoproteico
Una vez realizado el ensayo Xantoproteico la muestra resulta incolora por ende, da negativa y deducimos que la gelatina no presenta tirosina o triptófano.
Aspartamo
Procedimiento
Para su obtencion tomamos una punta de espatula de edulcorante y la colocamos en dos tubos de ensayo.
Posteriormente agregamos un poco de agua en cada uno de los tubos.Finalmente realizamos las reacciones mencionadas anteriormente.
Ensayos efectuados:
Biuret
Una vez realizado el ensayo de biuret , la solución no resulta de color violeta por lo tanto, la reacción da negativa y deducimos que el aspartamo no presenta enlaces peptidicos
Xantoproteica
Después de realizado el ensayo xantoproteico , la solucion resulta incolora .Por ende, la reaccion da negativa y deducimos que el aspartamo no presenta tirosina o triptófano
Glicina
Procedimiento:
Para su obtención colocamos una punta de espátula de la misma en un tubo de ensayo,aregamos un poco de agua y finalmente realizamos las reacciones previamente mencionadas
Biuret
Ensayos efectuados:
Biuret
Luego de realizado el ensayo, la reacción da negativa y deducimos que la glicina no presenta enlaces peptidicos.
Xantoproteico
Una vez realizado el ensayo, la solución resulta incolora por ende, la reacción da negativa y deducimos que el glicina no presenta tirosina o triptófano.
Suero de leche
Ensayos efectuados:
Biuret
La reaccion de Biuret nos dio positiva como muestra la foto por lo que podemos afirmar que existen enlaces peptidicos
Xantoproteico
La reaccion de Xantoproteico nos dio positivo por lo que pudimos deducir que la muestra contiene restos aromaticos
Proteínas 2(Diálisis)
Fundamento del procedimiento:
En bioquímica, la diálisis es el proceso de separar las moléculas en una solución por la diferencia en sus índices de difusión o presión osmótica a través de una membrana semipermeable.La diálisis es una técnica común de laboratorio, y funciona con el mismo principio que diálisis médica. Típicamente una solución de varios tipos de moléculas es puesta en un bolso semipermeable de diálisis como por ejemplo, en una membrana de la celulosa con poros, y el bolso es sellado. El bolso de diálisis sellado se coloca en un envase con una solución diferente, o agua pura. Las moléculas lo suficientemente pequeñas como para pasar a través de los poros (a menudo agua, sales y otras moléculas pequeñas) tienden a moverse hacia adentro o hacia afuera del bolso de diálisis en la dirección de la concentración más baja. Moléculas más grandes (a menudo proteínas, ADN, o polisacáridos) que tiene dimensiones significativamente mayores que el diámetro del poro son retenidas dentro del bolso de diálisis. Una razón común de usar esta técnica puede ser para quitar la sal de una solución de la proteína. La técnica no distinguirá efectivamente entre proteínas.
Ejecucion de la actividad e interpretacion de los resultados:
Materiales:
- Dializador(gomita elástica, botella cortada, papel selofan)
- Dializador(gomita elástica, botella cortada, papel selofan)
- Gelatina en solución
- AgNO3 (Nitrato de Plata)
- Vaso de Bohemia
- CuSO4 al 1 %
- NaOH al 10%
Procedimiento
PARTE1:
1) Colocar en dos tubos de ensayos muestra de la solución que se pondrá en el dializador.
2) Aplicarle la reacción de Biuret y AgNO3
3) Registrar las observaciones
En agua, tanto el nitrato de plata como el cloruro de sodio de disocian de la siguiente manera:
PARTE1:
1) Colocar en dos tubos de ensayos muestra de la solución que se pondrá en el dializador.
2) Aplicarle la reacción de Biuret y AgNO3
3) Registrar las observaciones
En agua, tanto el nitrato de plata como el cloruro de sodio de disocian de la siguiente manera:
AgNO3 (Ag +) + (NO3-) (ac)
Catión Plata Anión Nitrato
NaCl (Na+) + ( Cl -) (ac)
Catión Sodio Anión Cloruro
Para luego:
(Ag+) (ac) + (Cl-) (ac) AgCl (s)
Cloruro de Plata
El cloruro de plata es un sólido blanco, y es su formación lo que determina que el ensayo sea positivo o negativo.
Una vez realizados estos pasos, podemos observar que en ambos casos la reacción dio positiva, por lo que la solución tiene sales y proteínas.
PARTE 2:
1) Colocar dentro de un dializador una solución con proteínas y sales
2) Sumergir en un vaso de Bohemia con agua destilada( sin ningún desecho)
3) Luego de 25 minutos, tomar muestras de ambas partes del dializador.
4) Aplicar los ensayos anteriores .
5) Registrar las observaciones.
2) Sumergir en un vaso de Bohemia con agua destilada( sin ningún desecho)
3) Luego de 25 minutos, tomar muestras de ambas partes del dializador.
4) Aplicar los ensayos anteriores .
5) Registrar las observaciones.
Observaciones
Exterior
a) Biuret: NEGATIVO:no hay proteínas en la muestra.Significa que la membrana semi permeable del dializador retuvo las proteínas
b) AgNO3: POSITIVO:hay presencia de sales que anteriormente no había dentro del vaso de bohemia
Exterior
a) Biuret: NEGATIVO:no hay proteínas en la muestra.Significa que la membrana semi permeable del dializador retuvo las proteínas
b) AgNO3: POSITIVO:hay presencia de sales que anteriormente no había dentro del vaso de bohemia
Interior
a) Biuret: POSITIVO
b) AgNO3: POSITIVO
a) Biuret: POSITIVO
b) AgNO3: POSITIVO
Finalmente,en relación a estos últimos datos podemos afirmar que mientras que el ensayo de AgNO3 dio positivo,la concentracion de sales de la muestra disminuyó en gran proporción.Debido a que las proteínas de la muestra no lograron traspasar la membrana semi permeable del dializador,el ensayo de Biuret aplicado en esta muestra dio positivo.En conclusion,la diálisis fue exitosa.
Grupo:6º CB
Integrantes:-Chiara Bruno
-Florencia Loureiro
-Cecilia Giampietro